[mathjax]
絶対零度とは、熱力学における絶対温度Kの最低となる温度のことである。この絶対零度は摂氏-273.15℃である。この温度ではエントロピーとエンタルピーは0となる。
この温度になるとあらゆる物質は凍ると書いてあるものも多いが、実はヘリウムは単純に絶対零度になっただけでは固体にならない。
この記事では、そのようなヘリウムについて考えることで、希ガスの性質について考える。また、ヘリウムには安定した同位体が2種類存在するが、ここでいうヘリウムとは実際により多く存在する質量数4のヘリウムを指す。
参考:エントロピーの定義とは
参考:熱力学第〇法則まとめ
目次
ヘリウムとは
ヘリウムガスは、常温では飛行船の中身に使われるくらい軽く、吸うと声が高くなるものとして有名である。この気体は常圧下で約4K(-269℃)で液体に変化する。この沸点はあらゆる物質の中でも最も低い。ヘリウムよりも軽い水素分子のほうが融点が高いのである。
ヘリウムの相図
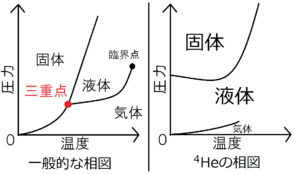
上の図は、一般的な物質の相図と質量数4のヘリウムの相図を表している。
ヘリウムの相図を見ると、絶対零度でも圧力がなければ液体の状態をとることがわかる。絶対零度の液体ヘリウムを固体にするには、25気圧もの圧力をかけなければならない(海抜0mの気圧が1気圧である)。
単原子分子とは
よく知られているように、ヘリウムの最外殻は電子で満たされているため、ヘリウム自身は化学反応をしにくい希ガスに分類される。ヘリウム原子同士で化学反応をすることもないため、原子一個で安定した状態となれる。この場合、ヘリウム原子1個で分子のようにふるまうことができる。このように、1個の原子のみで成り立つ分子のことを単原子分子とよぶ。
単原子分子間の相互作用と相転移
希ガスを構成している単原子分子間には相互作用引力が働いている。この引力は、原子核の周りに遍在する電子のゆらぎ(原子核の周りに遍在している電子が一部分にかたよること)によるファンデルワールス力のことである。逆に分子が近すぎて2つの原子の電子雲が重なると、パウリの排他律によって強い斥力が発生する。この引力と斥力が釣り合ったときの原子間距離が原子の直径となる。
この相互作用によって分子が規則正しく整列している状態が固体である。逆に、分子がこの相互作用を振り切るくらいに大きいエネルギーを持っていて、空間中を自由に飛び回っている状態が気体である。そしてこれらの中間で、完全には相互作用を振り切れていないが、分子の整列を崩すには十分なエネルギーを分子が持っている場合は液体となる。
希ガスのファンデルワールス力
分子間力が生まれる原因は数多くある。前述したファンデルワールス力の他にも、イオン間相互作用、双極子相互作用、水素結合が挙げられる。
ところが、希ガスの単原子分子間での相互作用による力は、ファンデルワールス力以外は無視できるほどに小さい。事実、希ガス原子はイオン化したり水素結合したりせず、さらに化学反応もせず電気陰性度の値はないため電気双極子も発生しない。したがって、希ガスの分子間力は、他の元素の分子間力よりも弱い。
よって、希ガスの融点と沸点は低くなる。
ヘリウムのファンデルワールス力
ただし、ヘリウム原子の質量は小さいため、他の希ガス原子と比べて動きやすい原子であるといえる。さらに、ファンデルワールス力は電子ゆらぎによるものだから、ファンデルワールス力は、その原子に含まれる電子が多いほど強くなる。ところがヘリウムの元素番号は2と小さいため、この引力は希ガスの中でも非常に弱いと推測される。
絶対零度で固体にならないということは、それだけヘリウム原子間の相互作用が弱いということである。
ヘリウムのほうが水素よりも固体になりにくい理由
最も一般的な水素の同位体は、質量数1の水素原子である。したがって、一般的な水素分子の質量数は2になる。一般的なヘリウムの質量数は4のため、水素分子のほうがヘリウム原子よりも質量が小さい。
ところが実験によると、ヘリウムのほうが水素よりも固体になりにくい。事実、水素の融点は約4K(-259.2℃)であり、常圧でも固体になれる。
この理由は、水素分子が2原子分子だからである。前述したとおり、ヘリウム原子の分子間力はファンデルワールス力以外は無視できるほど小さい。ところが水素分子は、ファンデルワールス力の他にも電気的引力が存在する。この電気的引力によって、水素は固体になりやすくなる。
まとめ
・ヘリウムは絶対零度でも固体にならない。固体にするには非常に大きな圧力をかける必要がある。
・ヘリウム原子間の引力は非常に弱いため、低温でも整列しにくい。
・ヘリウムに限らず、他の希ガスの融点・沸点も非常に低い。
参考文献
・大槻義彦編(1983)『物理学最前線3』,共立出版株式会社.