エントロピー\(S\)とは、系の乱雑さ・不規則性を表す指標である。基準状態を\(O\)としたときの状態\(A\)におけるエントロピー\(S_A\)は、次のように定義される。
$$S(A)=\int_O^A \frac{d’Q}{T}$$
また、エントロピーを使えば、熱力学第一法則を次のように書き換えることができる。
$$dU=TdS-pdV$$
エントロピー\(S\)とは、系の乱雑さ・不規則性を表す指標である。基準状態を\(O\)としたときの状態\(A\)におけるエントロピー\(S_A\)は、次のように定義される。
$$S(A)=\int_O^A \frac{d’Q}{T}$$
また、エントロピーを使えば、熱力学第一法則を次のように書き換えることができる。
$$dU=TdS-pdV$$
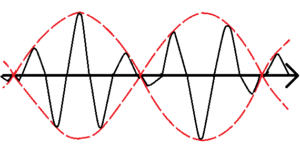
上図は、2種類の波が重なり合ってうなりが発生している様子を表している。波の振幅を赤い点線で結んだが、群速度\(v_g\)とは、この赤線で表した波が動く速度を表したものである。このことから、群速度はうなりの構造の速度とよく言われる。
$$v_g≡\frac{dω}{dk}$$
一方、黒い実線の波の速さは位相速度\(v_φ\)と呼ぶ。
$$v_φ≡\frac{\bar{ω}}{\bar{k}}$$
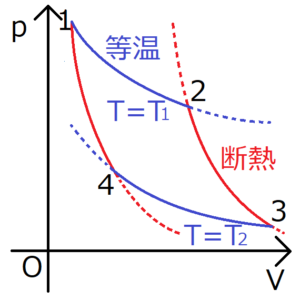
カルノーサイクルとは、等温過程と断熱過程という2種類の準静的過程で構成された熱機関のことである。
この記事では、このサイクルにおける仕事と熱効率の導出を行う。
系がした仕事を\(W’\)とおく。系Aがそれぞれの過程を経て系Bに至ったとき、次の式が成り立つ。
・定圧過程
一般的な気体:\(W’_{A→B}=p(V_B-V_A)\)
理想気体:\(W’_{A→B}=nR(T_B-T_A)\)
・等温過程
理想気体:\(W’_{A→B}=nRTln\frac{V_B}{V_A}\)
・断熱自由膨張
理想気体:\( \left( \frac{∂U}{∂V} \right) _T=0\)(ジュールの法則)
理想気体:\(C_p-C_V=nR\)(マイヤーの法則)
理想気体:\(dU=C_VdT\)
・断熱過程
理想気体:\(TV^{γ-1}=(定数)\)
理想気体:\(pV^γ=(定数)\)
温度\(T\)が一定のときに圧力\(p\)と体積\(V\)が反比例することをボイルの法則、圧力\(p\)が一定のときに体積\(V\)は温度\(T\)に比例することをシャルルの法則という。これらを1つの式で表したものをボイル-シャルルの法則と呼ぶ。
$$\frac{pV}{T}=C(一定)$$
理想気体とは、ボイル・シャルルの法則に正確に従うような気体のことである。理想気体の状態方程式とは次の式のことを指す。
$$pV=nRT$$
確率流密度\({\bf j}\)とは、粒子が存在する確率の流れを表すベクトルであり、次のように定義される。
熱容量とは、準静的に熱量を加える場合で、物体の温度を1K(ケルビン)上げるのに必要な熱量のことである。数式で表すと次のようになる。
また、定積熱容量\(C_V\)と定圧熱容量\(C_p\)は、それぞれ
この記事では、上の2式を導出する。
準静的過程とは、系に膨張・圧縮・加熱・冷却といった変化がゆっくり行われることで、常に平衡状態を保ちながら変化するような過程のことである。準静的過程によって変化した系は、その過程を逆向きにたどれば、再び元の状態に戻れるという特徴をもつ。
系の内部エネルギーの変化\(ΔU\)は、外部から系に入ってくる熱の総計\(Q\)と外部から系に加えられる仕事の総量\(W\)の和となる。これらの関係式を熱力学第一法則と呼ぶ。
$$ΔU=Q+W$$
また、本や教科書によっては、\(W\)を系が外部にする仕事と定義するものもある。この場合の熱力学第一法則は次のように定義される。
$$ΔU=Q-W$$